Reacciones de sustitución, de adición y de eliminación.
Reacciones orgánicas.
En una reacción orgánica, un compuesto orgánico se convierte en otro. Se rompen enlaces en los reactivos y se forman nuevos enlaces en los productos. Aunque la diversidad de reacciones es enorme, la mayoría se pueden agrupar en alguna de las siguientes categorías:
- Reacciones de sustitución. Un átomo o grupo de átomos es reemplazado por otra especie.
- Reacciones de eliminación. Implica la extracción de un par de átomos o grupos de átomos de carbonos adyacentes, dando como resultado un enlace múltiple (doble o triple). También, se pueden eliminar dos átomos de los extremos de una cadena lineal para obtener cadenas cíclicas.
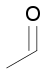
- Reacciones de adición. Se adicionan átomos o grupos de átomos, a los carbonos adyacentes de un enlace múltiple.
Sitios de reacciones orgánicas.
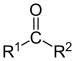
La reactividad de un compuesto orgánico está determinada por su estructura. Los sitios específicos de reacción tienden a ser átomos o grupos de átomos (grupos funcionales), en los que hay una disponibilidad o deficiencia de electrones.
El sitio rico en electrones de un reactivo, puede reaccionar entonces con el área deficiente en electrones de otro. Las regiones de un compuesto o ión que son deficientes en electrones, o positivos, tienden a atraer especies negativas o ricas en electrones y a aceptar electrones en una reacción química. Su contraparte son las regiones del compuesto que tienen alta densidad o disponibilidad de electrones, proporcionan los electrones en una reacción química.
Electrófilo. Es una especie deficiente en electrones, que acepta electrones de nucleófilos en una reacción química. Los electrófilos son ácidos de Lewis.
Nucleófilo. Es una especie con disponibilidad de electrones y que los dona a electrófilos en una reacción química. Los nucleófilos son bases de Lewis.
Base de Lewis. Sustancia con un par de electrones de capa externa no enlazante, los cuales puede compartir en una reacción química con un ácido de Lewis. Los nucleófilos son bases de Lewis.
Ácido de Lewis. Sustancia que en una reacción química, puede aceptar de una base de Lewis, un par de electrones para compartir. Los electrófilos son ácidos de Lewis.
Reacciones de sustitución.
Las reacciones de sustitución se caracterizan porque un átomo o grupo de átomos es reemplazado por otra especie.
Halogenación de alcanos.
La reacción entre un alcano y un halógeno, es una reacción de sustitución por un mecanismo de radicales libres. En presencia de luz, de peróxidos o a temperaturas entre 250°C y 400°C, los alcanos reaccionan con cloro o con bromo, dando origen a alcanos halogenados y desprendiendo el ácido halogenhídrico correspondiente. En estas reacciones, un átomo de halógeno sustituye a uno de hidrógeno y, generalmente, se rompen enlaces carbono-hidrógeno, pero no los enlaces carbono-carbono. Los hidrógenos de carbonos terciarios se sustituyen más fácilmente que los de carbonos secundarios y éstos a su vez que los terciarios.
Sello en honor a BerzeliusEl término “química orgánica" fue introducido en 1807 por Jöns Jacob Berzelius, para estudiar los compuestos derivados de recursos naturales. Se creía que los compuestos relacionados con la vida poseían una “fuerza vital” que les hacía distintos a los compuestos inorgánicos, además se consideraba imposible la preparación en el laboratorio de un compuesto orgánico, lo cual se había logrado con compuestos inorgánicos.
UreaEn 1928, Wöhler observó al evaporar una disolución de cianato de amonio, la formación de unos cristales incoloros de gran tamaño, que no pertenecían al cianato de amonio.






No hay comentarios.:
Publicar un comentario